Contenido:
- Justificación
- Objetivo
- Marco teórico (Ácidos, Bases y Sales)
- Evidencias
- Conclusión
- Web-biografía
1. Justificación
Esta investigación acerca de los diferentes compuestos químicos, servirá para obtener un conocimiento mas claro de su composición , elaboración y reacción en determinadas condiciones; ademas se beneficiaran las estudiantes del grado décimo y la comunidad educativa de Exalumnas de la presentación , a la cual va dirigida. Esto hará mucho mas sencillo el estudio de dichos compuestos y permitirá que las estudiantes se incentiven y comienzan a practicarla.
2. Objetivo General
Explicar de una manera mas concreta cada unos de los compuestos que se pueden crear a partir de unos determinados elementos químicos
2.1 Objetivos específicos
2.1.1 Definir cada uno de los compuestos químicos (Bases, Ácidos y Sales)
2.1.2 Analizar los elementos que componen los respectivos compuestos.
2.1.3 Explicar el proceso de creación de estos compuestos.
3. Marco teórico
3.1 Bases o Hidróxidos
Una base o álcali es cualquier sustancia que presente propiedades alcalinas. En primera aproximación (según Arrhenius) es cualquier sustancia que en disolución acuosa aporta iones OH− al medio.
Un ejemplo claro es el hidróxido potásico, de fórmula KOH:
KOH → OH− + K+ (en disolución acuosa)
- Hidroxido
Son un grupo de compuestos químicos formados por un metal, u otro catión, y uno o varios aniones hidroxilos, en lugar de oxígeno como sucede con los metales varios como es el sodio y el nitrógeno ya que estos se parecen demasiado por sus formas. El hidróxido, combinación que deriva del agua por sustitución de uno de sus átomos de hidrógeno por un metal, está presente en muchas bases.
- Propiedades de las bases
Finalmente, según Boyle, bases son aquellas sustancias que presentan las siguientes propiedades:
- Poseen un sabor amargo característico.
- Sus disoluciones conducen la corriente eléctrica.
- Cambian el papel tornasol rojo en azul.
- La mayoría son irritantes para la piel (cáusticos) ya que disuelven la grasa cutánea. Son destructivos en distintos grados para los tejidos humanos. Los polvos, nieblas y vapores provocan irritación respiratoria, de piel, ojos, y lesiones del tabique de la nariz.
- Tienen un tacto jabonoso.
- Son solubles en agua (sobre todo los hidróxidos).
- Reaccionan con ácidos formando sal y agua.
- Formación de una base
Una base se forma cuando un óxido metálico reacciona con agua (hidrólisis):
 ( Oxido de Magnesio + Agua ---> Hidróxido de Magnesio)
( Oxido de Magnesio + Agua ---> Hidróxido de Magnesio)igual es:
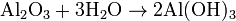
- ( Oxido de aluminio + 3 mol de agua----> 2 mol de Hidróxido de Aluminio)
- Nomenclatura de bases
Para crear una base usando diversas nomenclaturas para ellas tomadas a partir de los nombres de los elementos y juntándolos con un ion hidroxilo (OH), tomando el número de valencia del elemento y combinarlos (cambiándolos de posición) como se muestra en la tabla:
| Fórmula | Tradicional | Stock | IUPAC |
|---|---|---|---|
| Cu(OH) | Hidróxido cuproso | Hidróxido de cobre (I) | Monohidróxido de cobre |
| Cu(OH)2 | Hidróxido cúprico | Hidróxido de cobre (II) | Dihidróxido de cobre |
- Cuando un elemento tiene más de dos valencias no se le pone nomenclatura tradicional.
- Al usar la menor valencia, el elemento termina en oso y cuando se usa la mayor termina en ico.
- En la nomenclatura IUPAC se le va a dar una conformación de prefijos al elemento según su valencia usada (Mono, Di, Tri, Tetra, Penta, Hexa, etc) junto con la terminación -hidroxi u -oxidrilo que es el ion OH con carga −1.
- Ejemplos de bases
Algunos ejemplos de bases son:

- Soda cáustica (NaOH)
- Leche de magnesia (Mg(OH)2)
- El cloro de piscina (hipoclorito de sodio)
- Antiácidos en general
- Productos de limpieza
- Amoniaco (NH3)
- Jabón y detergente
- Bicarbonato de sodio
3.2 Ácidos
Un ácido es considerado tradicionalmente como cualquier compuesto químico que, cuando se disuelve en agua, produce una solución con una actividad de catión hidronio mayor que el agua pura, esto es, un pH menor que 7.

- Propiedades de los ácidos
- Tienen sabor agrio como en el caso del ácido cítrico en la naranja y el limón.
- Cambian el color del papel tornasol azul a rosa, el anaranjado de metilo de anaranjado a rojo y deja incolora a la fenolftaleína.
- Son corrosivos.
- Producen quemaduras de la piel.
- Son buenos conductores de electricidad en disoluciones acuosas.
- Reaccionan con metales activos formando una sal e hidrógeno.
- Reaccionan con bases para formar una sal más agua.
- Reaccionan con óxidos metálicos para formar una sal más agua.Ç
- Nomenclatura
En el sistema de nomenclatura clásico, los ácidos son nombrados de acuerdo a sus aniones. El sufijo iónico es eliminado y es reemplazado con un nuevo sufijo (y a veces prefijo), de acuerdo con la tabla siguiente.
| Prefijo Anión | Sufijo Anión | Prefijo Ácido | Sufijo Ácido | Ejemplo |
|---|---|---|---|---|
| per | ato | per | ácido ico | ácido perclórico (HClO4) |
| ato | ácido ico | ácido clórico (HClO3) | ||
| ito | ácido oso | ácido cloroso (HClO2) | ||
| hipo | ito | hipo | ácido oso | ácido hipocloroso (HClO) |
| uro | hidro | ácido ico | ácido clorhídrico (HCl) |
- División de los ácidos
Los ácidos se dividen en hidrácidos cuando no contienen oxígeno, como el ácido clorhídrico (HCl) y oxácidos si tienen oxígeno, como el ácido sulfúrico (H2SO4).1. Hidracidos
Son compuestos que están formados en su estructura por hidrógeno y no metal. En los hidrácidos el hidrógeno siempre tiene el número de oxidación de +1 .
Ejemplo:
(HF) Ácido Fluorhidrico
Ejemplo:
H Cl
- Nomenclatura de los hidracidos
(HF) Ácido Fluorhidrico
(HCL) Ácido Clorhidrico
(H2S) Ácido Sulfhidrico


- Obtención de hidracidos
HIDRÓGENO + NO METAL ----------> HIDRÁCIDO
H2 + F2 ----------> HF
H2 + Cl2 ----------> HCl
H2 + S ----------> H2S
- Usos de los hidracidos
2. Oxiacidos
Son compuestos que están formados en su estructura por hidrógeno, no metal y oxígeno. En los hidrácidos el hidrógeno siempre tiene el número de oxidación de +1 .
Ejemplo:
H ClO4
- Nomenclatura de Oxiacidos
Los oxiácidos se nombran anteponiendo la palabra ácido seguida del nombre del radical negativo correspondiente con la terminación OSO para el menor número de oxidación, e ICO para el mayor número de oxidación de las dos que posee, aquellos radicales donde el no metal posee cuatro valencias, la mínima lleva prefijo HIPO CON TERMINACIÓN OSO y la máxima llevar prefijo PER con terminación ICO.
(HCLO4) Acido Perclorico (Cloro con valencia +7)
(HCLO3) Acido Clorico (Cloro con valencia +5)
(HCLO2) Acido Cloroso (Cloro con valencia +3)
(HCLO) Acido Hipocloroso ( Cloro con valencia +1)

Observa que el cloro esta en el grupo VII
- Obtención de Oxiacidos
ANHÍDRIDOS + AGUA ----------> OXIÁCIDOS
Cl2 O7 + H2O ----------> HClO4
Cl2 O5 + H2O ----------> HClO3
Cl2 O3 + H2O ----------> HClO2
Cl2 O + H2O ----------> HClO
- Usos
2. El HNO3 al igual que los anteriores en la fabricación de fertilizantes, y en la fabricación de explosivos.
3. El H2CO3 Esta presente en bebidas gaseosas.
4. El H3PO4 en fertilizantes, detergentes es un ingrediente de la coca-cola
.
Los ácidos son usados frecuentemente para:
- Aplicaciones de los ácidos
Los ácidos son usados frecuentemente para:
- Eliminar herrumbre y otra corrosión de los metales en un proceso conocido como pickling.
- Electrolitos en una batería, como el ácido sulfúrico en una batería de automóvil.
- Procesamiento de minerales.
- Producción de fertilizantes,
- En la industria química, los ácidos reaccionan en las reacciones de neutralización para producir sales.
- Los ácidos carboxílicos pueden ser esterificados con alcoholes en presencia de ácido sulfúrico, para producir ésteres.
- Usados como catalizadores ( ácido sulfúrico es usado en grandes cantidades en el proceso de alquilación para producir gasolina)
- Los ácidos fuertes, como el ácido sulfúrico, fosfórico y clorhídrico, también tienen efecto en reacciones de deshidratación y condensación.
- Las sales hidratadas (que contienen agua de cristalización) se denominan indicando la sal correspondiente y seguidamente el número de moléculas de agua de hidratación.
- Aditivos en bebidas y alimentos, puesto que alteran su sabor y sirven como preservan tes.
- Las sales hidratadas (que contienen agua de cristalización) se denominan indicando la sal correspondiente y seguidamente el número de moléculas de agua de hidratación.
- Aditivos en bebidas y alimentos, puesto que alteran su sabor y sirven como preservan tes.
- Ejemplos de ácidos
Ácidos minerales o inorgánicos- Halogenuros de hidrógeno y sus soluciones acuosas: ácido clorhídrico (HCl), ácido bromhídrico (HBr), ácido yodhídrico (HI)
- Oxoácidos de halógenos: ácido hipocloroso, ácido clórico, ácido perclórico, ácido peryódico y compuestos correspondientes al bromo y al yodo
- Ácido fluorosulfúrico
- Ácido nítrico (HNO3)
- Ácido fosfórico (H3PO4)
- Ácido fluoroantimónico
- Ácido fluorobórico
- Ácido hexafluorofosfórico
- Ácido crómico (H2CrO4)
- Ácido metansulfónico (ácido mesílico)
- Ácido etansulfónico (ácido esílico) (EtSO3H)
- Ácido bencensulfónico (ácido besílico) (PhSO3H)
- Ácido toluenosulfónico (ácido tosílico) (C6H4(CH3) (SO3H))
- Ácido trifluorometansulfónico (ácido tríflico)
- Ácido acético
- Ácido fórmico
- Ácido glucónico
- Ácido láctico
- Ácido oxálico
- Ácido tartárico
- Ácido ascórbico
- Ácido de Meldrum
3.3 Sales
Una sal es un compuesto químico formado por cationes (iones con carga positiva) enlazados a aniones (iones con carga negativa) mediante un enlace iónico. Son el producto típico de una reacción química entre una base y un ácido, donde la base proporciona el catión y el ácido el anión.
- Nomenclatura
Según la nomenclatura tradicional, las sales se denominan con el nombre del anión, con cierto prefijo y sufijo, seguido de la preposición de y el nombre del catión. Hay que distinguir entre distintos casos:
- Las sales ácidas (sales que provienen de ácidos polipróticos y que contienen átomos de hidrógeno sustituibles) se denominan indicando el número de hidrógenos no sustituidos que quedan en la molécula, usando el prefijo correspondiente. Por ejemplo, el NaHS es la hidrogenosulfuro de sodio; el anión HS- proviene del ácido sulfhídrico.
- Las sales básicas (sales que contienen iones hidroxilo, OH-) se nombran indicando el número de hidroxilos seguido del anión central y finalmente el catión. Por ejemplo, el MgCl (OH) es el hidroxicloruro de magnesio
- Propiedades
Propiedades físicas
La dependencia de la solubilidad de algunas sales respecto a la temperatura.
En general, las sales son materiales cristalinos con estructura iónica. Por ejemplo, los cristales de haluros de los metales alcalinos yalcalinotérreos (NaCl, CsCl, CaF2) formados por aniones, situados al principio del empaquetamiento esférico más denso, y cationes que ocupan huecos dentro del paquete. Cristales de sal iónicos pueden ser también formados a partir de residuos de ácido combinados en un sinfín de estructuras dimensionales aniónicos y fragmentos de éstos con cationes en las cavidades (como los silicatos). Esta estructura se refleja apropiadamente en sus propiedades físicas: tienen altos puntos de fusión y en estado sólido son dieléctricos.
Color
Dicromato de potasio, una sal naranja brillante que se usa como pigmento
Dióxido de manganeso , una sal negra opaca

Las sales pueden tener la apariencia de ser claras y transparentes (como el cloruro de sodio), opacas e incluso metálicas y brillantes (como la pirita o sulfuro de hierro).
En muchos casos la opacidad o transparencia aparentes están relacionadas con la diferencia de tamaño de los monocristales individuales; como la luz se refleja en las fronteras de grano, los cristales grandes tienden a ser transparentes, mientras que los agregados policristalinos tienen la apariencia de polvo blanco.
Las sales pueden tener muchos colores diferentes. Algunos ejemplos son:
- Amarillo (cromato de sodio)
- Naranja (cromato de potasio)
- Rojo (ferricianuro de potasio)
- Malva (cloruro de cobalto (II))
- Azul (sulfato de cobre (II), azul de Prusia)
- Lila (permanganato de potasio)
- Verde (cloruro de níquel (II))
- Blanco (cloruro de sodio)
- Negro (óxido de manganeso (IV)
- Sin color (sulfato de magnesio)
La mayoría de minerales y pigmentos inorgánicos, así como muchos tintes orgánicos sintéticos, son sales. El color de la sal específica es debido a la presencia de electrones desparejados en el orbital atómico de los elementos de transición.
Gusto
Las diferentes sales pueden provocar todos los cinco diferentes sabores básicos como, por ejemplo, el salado (cloruro de sodio), el dulce (acetato de plomo (II), que provoca saturnismo si se ingiere), el agrio (bitartrato de potasio), el amargo (sulfato de magnesio) y el umami(glutamato monosódico)
Las sales de ácidos fuertes y bases fuertes (sales fuertes), no suele ser volátiles y no tienen olor, mientras que las sales tanto de bases débiles como de ácidos débiles (sal débil), pueden tener olor en forma de ácido conjugado (por ejemplo, acetatos como el ácido acético o vinagre, y cianuros como el cianuro de hidrógeno en las almendras) o en forma de base conjugada (por ejemplo, sales de amonio como el amoniaco) de los iones componentes. Esta descomposición parcial y lenta es usualmente acelerada en presencia de agua, ya que la hidrólisis es la otra mitad de la ecuación de la reacción reversible de formación de las sales débiles.
- Propiedades químicas
Las propiedades químicas vienen determinados por las propiedades de los cationes y aniones o una parte de ellos.
Las sales reaccionan con los ácidos y las bases, obteniéndose el producto de reacción y un gas precipitado o una sustancia tal como agua



Las sales reaccionan con los metales cuando éste se libera de la sal de metal en una serie electroquímica de reactividad:
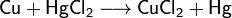
Las sales reaccionan entre sí y el producto resultante de la reacción (producen gas, y precipitan sedimentos o agua); estas reacciones pueden tener lugar con el cambio en losestados de oxidación de los átomos reactivos:



Algunas sales se descomponen cuando se calientan:
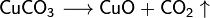
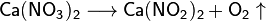


- Clasificaciones
Las sales se pueden clasificar en los siguientes grupos:
Sal haloidea, hidrácida o binaria neutra: Son compuestos binarios formados por un metal y un no-metal, sin ningún otro elemento. El anión siempre va a tener la terminación-uro. Ejemplos: cloruro de sodio, NaCl; cloruro de hierro (III), FeCl3; sulfuro de hierro (II), FeS.
Sal de oxácido: Procede de sustituir los hidrógenos de un oxácido por cationes metálicos.
Sal oxácida, oxiácida o ternaria neutra: se sustituyen todos los hidrógenos. Ejemplo: hipoclorito de sodio, NaClO.
Sal ácida: Se sustituyen parte de los hidrógenos. Ejemplo: hidrogenocarbonato de sodio o bicarbonato de sodio, NaHCO3.
Sal básica o hidroxisal: Contienen iones hidróxido (OH-), además de otros aniones. Se pueden clasificar como sales o hidróxidos. Ejemplo: hidroxicarbonato de hierro (III), Fe(OH)CO3.
Sal doble: Se sustituyen los hidrógenos por dos o más cationes. Ejemplo: carbonato doble de potasio y litio, KLiCO3.
Hidroxosal: Sal formada a partir de un hidróxido anfótero, que reacciona como un ácido una base débil ante una base o un ácido fuerte.Al(OH)3 + 3 Na(OH) → Al(OH)6Na3 (hexahidroxoaluminato de sodio)Al(OH)3 + 3 HCl → AlCl3 (cloruro de aluminio) + 3 H2O
Sal mixta: Contiene varios aniones. Ejemplos: clorurofluoruro de calcio, CaClF; clorurofosfato de potasio, K4ClPO4, nitratosulfato de hierro (III), Fe(NO3)SO4.
Oxisal: formada por la unión de un óxido y una sal. Ejemplos: oxinitrato de plomo (IV), PbO(NO3)2; oxicloruro de cobalto (III), CoOCl.
Sal hidratada o hidrato: sal con moléculas de agua en su estructura cristalina. Ejemplos: óxido de plomo (III) hemihidrato (o hemihidratado), PbO·½H2O; sulfato de calcio dihidrato, CaSO4·2H2O.
Como puede verse en la clasificación de arriba, tanto las sales haloideas como las sales oxácidas, son llamadas «sales neutras».
- Localizacion
Las sales se encuentran o bien en forma de mineral como parte de las rocas (como la halita), o bien disueltas en el agua (por ejemplo, el agua de mar). Son un componente vital de los seres vivos, en los que las podemos encontrar de diferentes formas:
- Disueltas dentro de los organismos en los iones que las constituyen, los cuales pueden actuar en determinados procesos biológicos:
- Transmisión de los impulsos nerviosos
- Contracción muscular
- Síntesis y actividad de la clorofila
- Transporte del oxígeno de la hemoglobina
- Cofactores que ayudan a las enzimas
- Formando parte de estructuras sólidas insolubles que proporcionan protección o sostenimiento (huesos, conchas...)
- Asociadas a moléculas orgánicas: hay iones que son imprescindibles para la síntesis de algunas biomoléculas (como por ejemplo el yodo para las hormonas fabricadas en laglándula tiroides), o para determinadas funciones (por ejemplo, el ion fosfato asociado a lípidos forma los fosfolípidos de la membrana celular; fosfoproteínas como lacaseína de la leche, la molécula de hemoglobina que contiene hierro ...)
- Soluciones salinas
- Una solución salina es el resultado de la reacción de un ácido fuerte con una base fuerte. Resulta altamente ionizada y, por ello, neutra. La explicación es que los contra iones de los ácidos fuertes y las bases débiles son bastante estables, y por tanto no hidrolizan al agua. EJ: el cloruro sódico, el bromuro de litio y otras.
- Químicamente: Una solución salina de un ácido débil con una base fuerte es básica. El mecanismo es el mismo que en caso anterior: el ácido, al ser débil, tenderá a captar un protón, que debe proceder necesariamente de la hidrólisis del agua. EJ: disolución en agua del acetato de sodio.
- Comúnmente se le llama solución salina a la mezcla de sal común(NaCl) y agua, en esta mezcla la sal.
- Una solución salina de un ácido fuerte con una base débil es ácida. Esto es así porque, tras disociarse la sal al disolverse, la base débil tiene tendencia a captar OH-,hidróxidos que va a obtener hidrolizando el agua. Finalmente, tenemos un exceso de iones hidronio en disolución que le confieren acidez a la disolución.
- Importancia biológica
Las sales químicas pueden tener varias funciones:
- Función estructural: las sales sólidas forman la estructura de los minerales y las estructuras esqueléticas (externas o internas) de protección y de sostenimiento de los organismos.
- Función reguladora:
- Función del tampón del pH: las sales son sustancias que regulan el pH de una disolución.
- Presión osmótica: la ósmosis es un fenómeno que se produce cuando hay dos disoluciones diferentes de concentraciones diferentes separadas por una membrana semipermeable que permite el paso de las sustancias de bajo peso molecular. Tiene la función de igualar las dos disoluciones de manera que tengan la misma concentración mediante el paso del disolvente.
- Funciones específicas: muchas sales o sus iones son necesarios para determinados procesos biológicos como la contracción muscular, la transmisión de impulsos nerviosos, etc.
4.Conclusión
Como resultado de esta investigación es posible concluir que la formación de las sales no se podría concretar sin la existencia de los ácidos o de las bases. Ademas de ser indispensables tanto en la vida diaria de los individuos como en los experimentos de los laboratorio y los procesos industriales. Es muy relevante conocer la composición de cada uno de estos compuestos ya que hacen posibles muchos de los productos y actividades que nosotros como seres humanos realizamos en nuestra vida cotidiana.
5. Web- Biografía
https://es.wikipedia.org/wiki/Hidr%C3%B3xido
https://es.wikipedia.org/wiki/Base_(qu%C3%ADmica)
http://tiempodeexito.com/quimicain/23.html
https://es.wikipedia.org/wiki/%C3%81cido#Definiciones_y_conceptos
http://www.tipos.co/tipos-de-acidos/
http://tiempodeexito.com/quimicain/23.html
https://es.wikipedia.org/wiki/%C3%81cido#Definiciones_y_conceptos
http://www.tipos.co/tipos-de-acidos/



















No hay comentarios:
Publicar un comentario